Praktikum im Heidelberger Life-Science Lab des dkfz
vom 23. Juli bis zum 3. August 2018
Von Laureen Hippen, Tram Huynh, Luca Münzel und Hannah Schmidt
Dank eines Stipendiums im Rahmen der Auricher Wissenschaftstage durften wir, Laureen Hippen, Tram Huynh, Luca Münzel und Hannah Schmidt, ein zweiwöchiges Praktikum (23.07.2018–03.08.2018) am Life-Science-Lab des Deutschen Krebsforschungszentrums in Heidelberg absolvieren.
Das Praktikum, welches sich vorrangig durch Laborarbeit auszeichnete, startete mit einer Vorstellungsrunde, in der wir nicht nur die Leiterin des Praktikums, Anja Reimann, kennenlernten, von der wir äußerst herzlich aufgenommen wurden, sondern auch die vier weiteren Praktikanten, die sich durch ihre Teilnahme am Wettbewerb „Jugend forscht“ für das Praktikum qualifiziert hatten.
Mit dem Ziel des Erwerbs eines Laborführerscheins begaben wir uns in das Labor, in welchem wir in den folgenden Tagen nicht nur im Bereich der Molekularbiologie, sondern auch der Zellbiologie und der Proteinbiochemie arbeiten sollten.
Begonnen haben wir mit den proteinbiochemischen Methoden, durch welche wir die SDS-PAGE kennenlernten. Zur Bestimmung und Charakterisierung von Proteinen stellten wir ein eigenes SDS-Gel her, in dem die diskontinuierliche Gelelektrophorese stattfand.
Nach der Zerstörung der Sekundär-, Tertiär- und Quartärstruktur der Proteine und der damit einhergehenden Ausbildung von Protein-SDS-Komplexen durch bestimmte Chemikalien beginnen die Proteine damit, sich ihrer Größe entsprechend im elektrischen Feld des Gels zu bewegen und anzusammeln. Um einen Tag später die Größenunterschiede der Proteine zu erkennen und sichtbar machen zu können, begannen wir mit der Coomassiefärbung. Mit Hilfe eines Fotometers führten wir dann die Konzentrationsbestimmung von Proteinen nach Bradford durch.
Unsere nächste Aufgabe bestand darin, Agar vorzubereiten und anschließend als Agarplatten zu gießen. Hiermit betraten wir den Bereich der Molekularbiologie, in dem wir uns zuerst mit dem Wachstum von Bakterien beschäftigten. Agarböden dienen nämlich als Nährboden für Bakterien, auf denen über Nacht ganze Kolonien heranwuchsen. Zudem konnte damit die Resistenz der Bakterien gegen bestimmte Antibiotika nachgewiesen werden, da die Bakterien nur auf den Platten mit dem Antibiotikum wuchsen, gegen das sie resistent waren.
Des Weiteren haben wir mittels einer alkalischen Lyse eine Plasmid-Minipräparation durchgeführt, die eine Methode zur Isolierung der Plasmid-DNA ist, welche sich im Gegensatz zur chromosomalen DNA und den ebenfalls mit enthaltenen Proteinen nach einer Denaturierung wieder renaturieren kann. Nach der Renaturierung zerlegten wir die Plasmid-DNA mit Restriktionsenzymen in lange DNA-Moleküle. Um diese DNA-Fragmente sichtbar zu machen, gossen wir ein Agarosegel, auf welchem die isolierten Fragmente nach gelelektrophoretischer Auftrennung unter UV-Licht sichtbar gemacht werden konnten, in eine Gelkammer.
In unserem letzten Thema der Woche, der Zellbiologie, konnten wir zuerst an der Sterilwerkbank arbeiten. Hierbei sollten wir die HeLa-Zellen, also Gebärmutterhalskrebszellen der Henrietta Lacks, steril überführen, damit sie zur Weiterzucht verwendet werden konnten.
Zudem arbeiteten wir erstmals mit Jurkat-Zellen, also Leukämiezellen, deren Zellzahl wir zunächst mit Hilfe der Neubauer-Zählkammer ermitteln sollten. Anschließend nutzten wir die Jurkat-Zellen, um den programmierten Zelltod (Apoptose) durch Zugabe einer unterschiedlich hohen Menge eines Todesliganden einzuleiten.
Zudem lernten wir auch durch das Erhitzen der Jurkat-Zellen, durch welche diese unkontrolliert zerplatzten, die Nekrose kennen. Bereits am nächsten Tag konnten wir durch das Durchflusszytometer erkennen, wie viele lebende Zellen übrig geblieben waren.
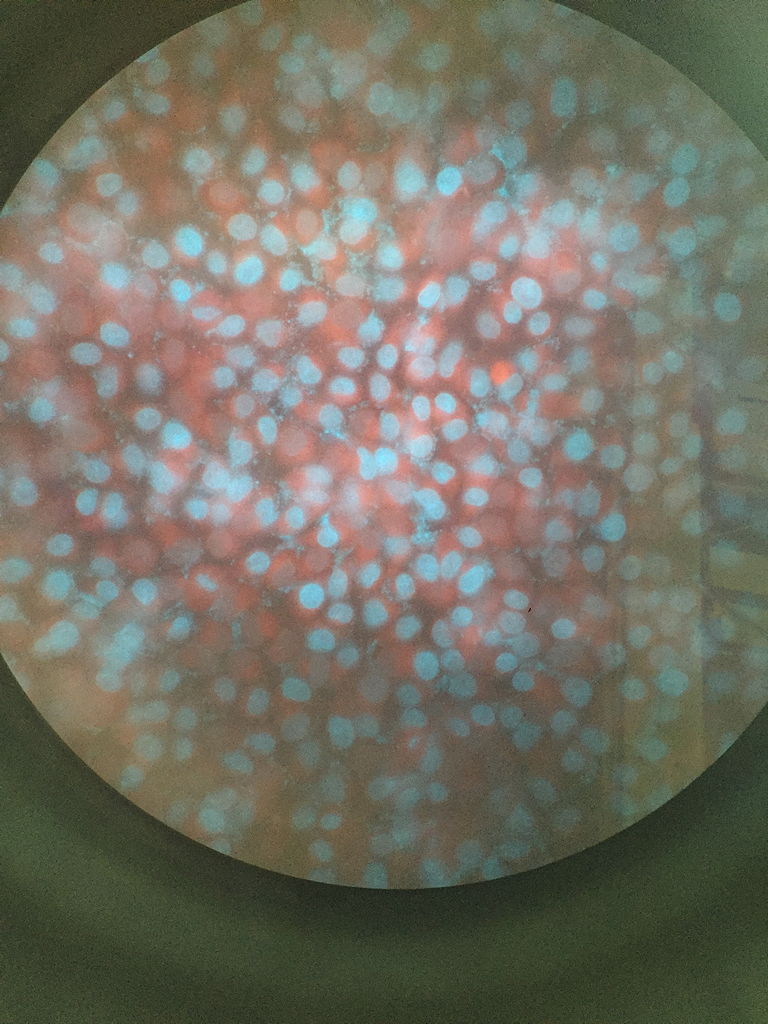
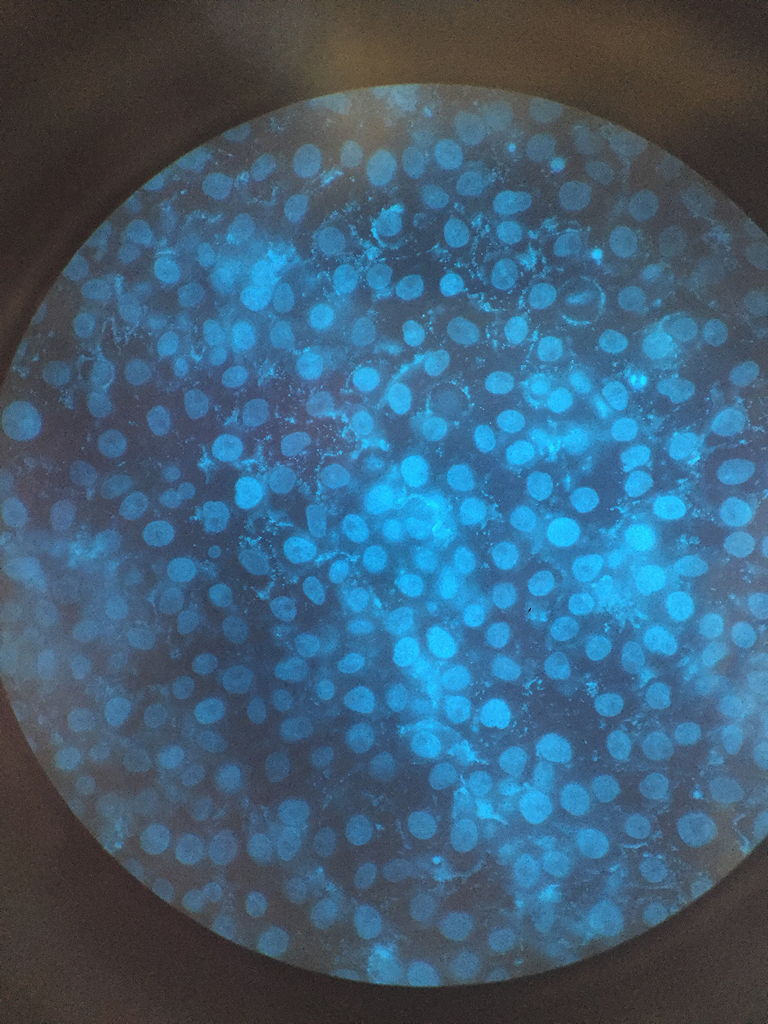
Nach dieser sehr spannenden und lehrreichen ersten Woche beschäftigten wir uns über die zweite Woche verteilt mit der Fluoreszenzmikroskopie. Als eine zentrale Methode der Zellbiologie sollte es uns damit ermöglicht werden, einzelne Bestandteile der Zellen darzustellen und Organellen oder Proteine zu lokalisieren und nachzuweisen. Um dies zu erreichen, arbeiteten wir ein zweites Mal an der Sterilwerkbank, an der wir HeLa-Zellen in eine 6-Well-Platte ausplattierten, um sie anschließend einzufärben und auf Präparate zu überführen.
Zudem lernten wir das PCR-basierte Nachweisverfahren kennen, zu dem die semi-quantitative PCR und die Colony-PCR zählen. Ziel der Polymerase-Ketten-Reaktion ist es, bestimmte DNA-Segmente beliebig oft zu kopieren und vorliegende Gensequenzen zu erkennen. Mit dieser Information können beispielsweise Mutationen in Genen untersucht werden, was in der medizinischen Diagnostik die Vorsorge oder Behandlung einer Erkrankung erleichtert. Dementsprechend haben wir bei der semi-quantitativen PCR zunächst die DNA hitzedenaturiert, um die DNA-Stränge voneinander zu trennen. Im folgenden Schritt, der auch Annealing genannt wird, haben wir an den gewünschten DNA-Abschnitt einen komplementären Primer angelegt, um dann im letzten Teil der PCR, der Elongation, die neuen DNA-Stränge zu synthetisieren. Die Colony-PCR läuft ähnlich ab, bis auf den Unterschied, dass hier lebende Bakterien hinzugefügt werden, um bei einer bakteriellen Infektion die medizinische Diagnostik zu erleichtern.
Neben der Laborarbeit wurde uns in der zweiten Woche zudem die Möglichkeit geboten, verschiedene Abteilungen des DKFZ zu besuchen.
Unsere Vortragsreihe startete mit einem Besuch bei Thomas Fiedler, der uns den 7-Tesla-MRT erklärte, welches ein Tomograph mit einer deutlich höheren Magnetfeldstärke als in Kliniken üblich ist. Diese Besonderheit weist auch die Wichtigkeit des MRT für das DKFZ auf, da es bislang nur 60 Geräte weltweit gibt, mit denen eine so genaue Magnetresonanzbildgebung und Spektroskopie möglich ist.
Anschließend besuchten wir das Zentrum für Präklinische Forschung, in welchem uns Larissa Ziegler die Bedeutung der Mäuse und Ratten, die in der Tierforschung als Versuchstiere überwiegen, in der biomedizinischen Grundlagenforschung erklärte. Dabei wurde uns bewusst, dass Tierversuche unter strikten Vorlagen ablaufen, die auch artgerechte Haltung beinhalten.
Neben diesen anschaulichen Vorträgen bekamen wir auch einen Einblick in die tägliche Arbeit mit Zellen, die weit über das hinausgeht, was wir in unserer ersten Woche gelernt hatten.
Dazu besuchten wir die BTA Yvette Dörflinger, die auf die Arbeit am Elektronenmikroskop spezialisiert ist. Ihre Arbeit ist von der Präparation bis zur Analyse der Proben mit einer Zeit von drei Wochen sehr aufwändig, jedoch auch von großer Bedeutung, da durch die Arbeit mit einem Elektronenmikroskop eine höhere Auflösung als durch ein Lichtmikroskop erreicht werden kann.
Zudem bekamen wir durch Dr. Angela Schulz einen Einblick in die Sequenzierung eines Genoms, wodurch der DNA-Code entschlüsselt werden kann. Besonders faszinierend an dieser Methode ist, dass so Mutationen detektiert und Tumorgewebe isoliert von gesundem Gewebe betrachtet werden kann, was spezifische Therapien gegen Mutationen erleichtert.
Auch wurde uns ein Einblick in die Stabsstelle Strahlenschutz und Dosimetrie durch den Physiker Jens Lang gegeben und wir hatten die Möglichkeit, uns nicht nur die Herstellung von körperähnlichen Imitaten in der Medizintechnik durch Armin Runz erklären, sondern auch zur Veranschaulichung von ihnen produzierte Modelle, wie das einer Lunge, zeigen zu lassen.
In wirklichen Kontakt mit dem Thema Krebs und der Arbeit mit Patienten traten wir bei dem Besuch des Krebsinformationsdienstes (KID). Der KID, welcher sich viel Zeit für den Anrufer durch fachkundige Angestellte nimmt, dient als Anlaufstelle sowohl für Betroffene und Angehörige als auch für interessierte Bürger und Fachleute.
Auch im Nationalen Centrum für Tumorerkrankungen (NCT) erhielten wir einen Einblick in die Patientenversorgung, indem uns die Möglichkeit geboten wurde, an einer Teambesprechung der Sportmediziner des Centrums teilzunehmen. Das NCT beschäftigt sich unter anderem mit sport- und bewegungstherapeutischer Beratung und Betreuung, um die körperliche Fitness und das allgemeine Wohlbefinden der Patienten zu steigern und die durch eine Chemotherapie hervorgerufenen Nebenwirkungen zu lindern.
Insgesamt kann gesagt werden, dass wir nicht nur im Labor praktisch arbeiten konnten und so Methoden erlernen durften, die uns ohne dieses Praktikum verwehrt geblieben wären, sondern dass wir auch die Chance hatten, uns im theoretischen Bereich weiterzubilden und das Thema rund um Tumore und deren Behandlung genauer zu erforschen.
Abschließend möchten wir uns bei den Auricher Wissenschaftstagen sowie besonders dem Heidelberger Life-Science-Lab und Anja Reimann bedanken, dass uns die Möglichkeit gegeben wurde, über den schulischen Horizont hinauszublicken und einmalige Erfahrungen machen zu können.
Laureen Hippen, Tram Huynh, Luca Münzel und Hannah Schmidt