Praktikum vom 17.07.2022 zum 29.07.2022
von Paulina Claaßen, Hanna Erdwiens und Lara Visser
Dank der Auricher Wissenschaftstage hatten wir, Paulina Claaßen, Hanna Erdwiens und Lara Visser, die einzigartige Möglichkeit,während der Sommerferien vom 17.07.2022 bis zum 29.07.2022 ein Praktikum am Deutschen Krebsforschungszentrum (DKFZ) in Heidelberg zu absolvieren.
Unser Praktikum startete mit einer herzlichen Begrüßung durch Frau Anja Klefenz und Frau Angela Funk, die uns in den zwei Wochen betreut und angeleitet haben. Zunächst wurde uns von ihnen das Heidelberger Life-Science Lab vorgestellt, in dem wir die darauffolgenden zwei Wochen arbeiten durften. Daraufhin führten sie eine Sicherheits- und Pipetteneinwei-sung mit uns durch und klärten uns über das Gentechnikgesetz auf, sodass wir bereits am Nachmittag mit unserem ersten Themenschwerpunkt, den proteinbiochemischen Methoden, beginnen konnten.
Proteinbiochemische Methoden
Protein-Gelelektrophorese
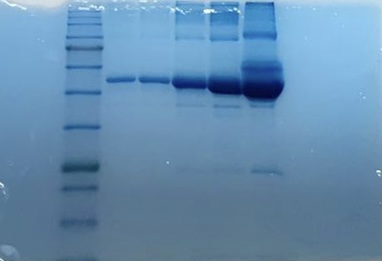
Zu Beginn führten wir eine diskontinuierliche Protein-Gelelektrophorese durch. Dafür gossen wir unsere eigenen SDS-Gele aus zwei Gelen, einem Sammelgel und einem Trenngel. Das Sammelgel diente dazu, die Proteine vor dem Trennvorgang auf eine Ebene zu bringen. Im Gegensatz dazu trennte das Trenngel die Proteine der Größe nach in einem elektrischen Feld. Damit die Proteine sich nur der Größe, nicht auch der Ladung nach, trennten, lagerte sich das SDS an die Proteine an und besetzte die Oberfläche mit negativen Ladungen.
Einen Tag später bereiteten wir die Proben für die Gelelektrophorese vor und belu-den das selbstgegossene Gel mit diesen. Als Protein-Proben nutzten wir ein isolier-tes Protein (BSA) mit verschiedenen Konzentrationen und ein Proteingemisch (FCS) mit einer unbekannten Konzentration.
Danach färbten wir die SDS-PAGE über Nacht mit einer Coomassie-Färbelösung, um die Banden sichtbar zu machen. Am darauffolgenden Tag entfärbten wir das Gel mit einer Entfärbelösung, damit nur noch die Banden farbig zu sehen waren.
Anhand unserer Ergebnisse ließ sich schlussfolgern, dass das BSA-Protein ein isolier-tes Protein ist und jeweils nur eine Größe von dem Protein vorhanden ist, da jeweils nur eine Bande deutlich zu sehen war. Jedoch sieht man auf der Abbildung mehrere Banden, da das BSA nur eine Reinheit von 95% hatte. Die Breiten der Banden spie-gelten die unterschiedlichen Konzentrationen der verschiedenen Protein-Proben wi-der. FCS enthält mehrere Proteine, der Hauptbestandteil ist BSA, weshalb diebreites-te Bande auf der gleichen Höhe wie das BSA liegt. Die Bande des FCSs (ganz rechts in der Abbildung) war deutlich breiter, somit war die Konzentration des Proteingemi-sches (FCS) deutlich zu hoch.
Proteinbestimmung
Im Anschluss wandten wir die Proteinbestimmung nach Bradford an, um die unbe-kannte Konzentration des FCS-Proteingemisches genauer bestimmen zu können. Da-zu bereiteten wir verschiedene Proteinbestimmungslösungen mit unterschiedlichen Konzentrationen des BSA-Proteins und des FCS-Proteingemisches vor. Diese färbten wir mit einem Färbemittel ein und überführten sie in Küvetten. Mithilfe eines Spekt-ralphotometers konnten wir die Absorptionsstärke der verschiedenen Konzentratio-nen messen. Durch den Vergleich konnten wir dem FCS-Proteingemisch eine Kon-zentration zuordnen.
Molekularbiologie
Minipräp
Für die Minipräp pickten wir als erstes kanamycin-resistente Bakterien und setzten eine Übernachtkultur an. Am nächsten Tag ernteten wir die Bakterien und zentrifu-gierten sie. Danach versetzten wir sie mit einem P1-Puffer, der RNase enthält. Als nächstes fügten wir unserer Bakteriensuspension einen P2-Puffer hinzu, der sowohl NaOH als auch SDS enthielt, wodurch sich die Phospholipide und Proteinkomponen-ten der Zellwände lösten und die Plasmid-DNA aus der Zelle gelangen konnte. Damit nur die Plasmid-DNA aus der Zelle strömte, wurde die Reaktion nach fünf Minuten Inkubationszeit durch einen P3-Puffer mit einen pH-Wert von 5,5 gestoppt. Infolge-dessen denaturierten die restlichen Zellbestandteile, die im Anschluss abzentrifu-giert wurden. Somit konnte die reine Plasmid-DNA abpipettiert werden. Damit die Plasmid-DNA uns für weitere Experimente zur Verfügung stehen konnte, wurde sie mit Ethanol gefällt und gewaschen.
Transformation
Die Plasmid-DNA mit der darin enthaltenen Resistenz gegenüber Kanamycin trans-formierten wir in kompetente Bakterien. Diese strichen wir auf drei Agarplatten aus. Die ersten beiden waren mit dem Antibiotikum Kanamycin und die dritte mit dem Antibiotikum Ampicillin versetzt, gegen das die Bakterien nicht resistent waren. Auf eine der mit Kanamycin versetzten Agarplatten wurde statt der normalen Bakterien-suspension, eine Verdünnung von 1:100 ausgestrichen.
Nach einer Nacht Inkubationszeit wurde sichtbar, dass die Bakterien nur auf den Agarplatten wachsen konnten, die mit Kanamycin versetzt waren (in der Abbildung mittigund rechts). Auf der mit Ampicllin versetzten Agarplatte überlebten die Bakte-rien nicht (in der Abbildung links).
Restriktionsanalyse
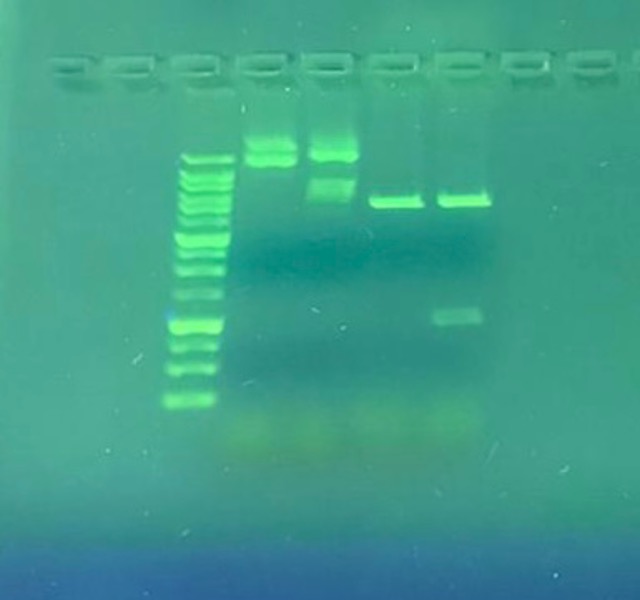
Mit der Plasmid-DNA der Minipräp erfolgte die Restriktionsanalyse. Hierfür zerlegten wir lange DNA-Stränge mithilfe von Restriktionsendonukleasen (BamHI; HindIII) in zwei DNA-Fragmente. Nach gelelektrophoretischer Auftrennung der DNA-Stränge im Agarosegel der Größe nach war es möglich, die DNA-Fragmente unter UV-Licht sichtbar zu machen.
Der Abbildung ist zu entnehmen, dass die ersten beiden Proben nicht durch die Rest-riktionsendonukleasen geschnitten wurden, daher haben sie ihre ringförmige Struktur behalten und waren weit oben an geordnet. Wohingegen die letzten beiden Proben weiter unten angeordnet waren, weil sie mit Restriktionsenzymen zerlegt wurden. Obwohl die DNA-Stränge der dritten und vierten Probe in zwei Teile geschnitten wurden, war bei der dritten Probe nur eine Bande sichtbar. Ein Teil dieser Probe be-stand nämlichaus lediglich 40 Basen und war somit zu kurz, um ihn sehen zu können.
Zellbiologie
Steriles Arbeiten mit Hela-Zellen
Da alle Arbeiten der Zellkulturen unter der sterilen Arbeitsbank durchgeführt werden, wurden wir zunächst über die Grundregeln für steriles Arbeiten aufgeklärt. Um diese Erkenntnisse praktisch umzusetzen, passagierten und kultivierten wir humane epitheliale Zellen (HeLa-Zellen). Einen Teil der Zellen haben wir aus dem Medium entfernt und diesen zur Weiterzucht in eine neue Zellkulturflasche umgesetzt. Die Zellen wurden dann mit neuen Nährstoffen versorgt.
Zellzählung und Zelltod
Zur Ermittlung der Konzentration von Jurkat T-Zellen verwendeten wir zum Zählen der Zellen die Neubauer-Zählkammer.
In einen Teil der Jurkat T-Zellen, deren Konzentration uns durch die Zellzählung unter dem Mikroskop bekannt war, induzierten wir mit verschiedenen Konzentrationen eines Todesliganden eine Apoptose. Den anderen Teil der Zellen erhitzten wir, um bei diesen eine Nekrose auszulösen.
Mit dem Durchflusszytometer konnten wir den Anteil der überlebenden Zellen bestimmen. Sichtbar wurde, dass bei steigender Konzentration des Todesliganden der Anteil der lebenden Zellen sank. Darüber hinaus verglichen wir die Morphologie der nekrotischen Zellen mit der der apoptotischen Zellen. Während die nekrotischen aufplatzten, wurden die apoptotischen Zellen zu Körperchen abgeschnürt.
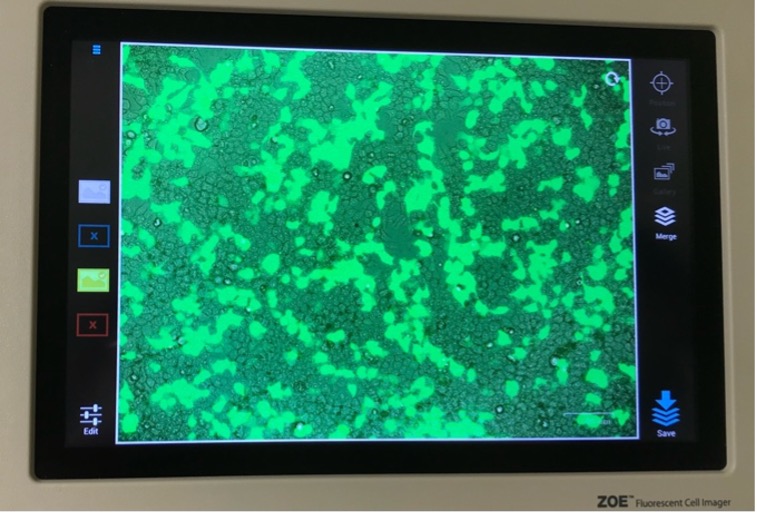
Als letztes transfizierten wir humane epitheliale Zellen (Hek 293T) mit der Kalzi-umphosphat-Methode. Dazu generierten wie DNA-Kalziumphosphatkristalle, die sich an die mit Fluoreszenz versetzte Plasmid-DNA aus unserer Minipräp anlagerte. An-schließend pippetierten wir dies zu den adhärenten Zellen. Über Nacht wurden die DNA-Kalziumsphosphatkristalle mittels Phagozytose von der Zelle aufgenommen. Am nächsten Tag leuchteten die Zellen, die die Plasmidkristalle aufgenommen hat-ten, unter dem Fluoreszenzmikroskop grün.
Transfektion
In der zweiten Woche fiel der Laborteil unseres Praktikums aufgrund einer Corona-Erkrankung im Team des Life-Science Labs leider aus. Zum Glück konnten wir trotzdem viele verschiedene Abteilungen des DKFZs besuchen.
Abteilungsbesuche
Zentrum für präklinische Forschung
Unser erster Abteilungsbesuch fand im Zentrum für präklinische Forschung des DKFZs statt. Frau Dr. Lena Hornetz stellte uns ihren Berufsalltag als Tierärztin in dieser Abteilung vor. Bevor wir die Tierhaltung besichtigen konnten, mussten wir Schutzkleidung überziehen, da die Tiere kein Immunsystem haben. Des Weiteren klärte Frau Dr. Hornetz uns darüber auf, dass die Tiere von Wissenschaftlern für Tierversuche im Bereich der Krebsforschung eingesetzt werden. Bei den Tieren handelt es sich um ca. 50000 Mäuse, 50 Ratten und ein paar wenige Meerschweinchen. Ein spezialisiertes Team von Tierärzten und Tierpflegern kümmert sich tagtäglich um die Tiere. Der Umgang mit den Tieren ist gesetzlich vorgeschrieben und wird durch regelmäßige, unangekündigte Besuche durch das Veterinäramt überprüft.
Stabsstelle Strahlenschutz und Dosimetrie
Als nächstes präsentierte uns Dipl.-Physiker Jens Lang die Abteilung für Strahlenschutz und Dosimetrie. In einer kurzen Präsentation erfuhren wir, dass diese Abteilung für die radiologische Sicherheit des Forschungszentrums und die Umsetzung der Strahlenschutzvorschriften verantwortlich ist. Darüber hinaus erklärte uns Herr Lang mithilfe von kurzen Videos die Grundlagen der radioaktiven Strahlung und dessen Auswirkungen auf den menschlichen Organismus.
Krebsinformationsdienst
Am darauffolgenden Tag hörten wir einen Vortrag von Frau Dr. Eva Krieghoff-Henning über den Krebsinformationsdienst (KID). Sie informierte uns über die Entstehung, Diagnose, Prävention und Behandlung von Krebs und schilderte uns die Aufgaben ihrer Abteilung. Der KID ist ein Angebot des DKFZs für Menschen mit Krebs, ihre Familien und Freunde sowie für alle Ratsuchenden, sich evidenzbasiert und unabhängig zu informieren. Frau Dr. Krieghoff-Henning und andere Ärzte beantworten kostenlos Fragen zum Thema Krebs in verständlicher Form, am Telefon oder per E-Mail.
Durchflusszytometrie
Anschließend wurde uns die Durchflusszytometrie von Herrn Dr. Marcus Eich vorgestellt. In einer Präsentation erklärte er uns, dass ein Durchflusszytometer eine große Zellenzahl in kurzer Zeit analysieren und sortieren kann. Dabei kann das Gerät gesunde, apoptotische und nekrotische Zellen voneinander unterscheiden und trennen. Dazu werden die Zellen mit einem Laser angestrahlt, wodurch sie ein charakteristisches Streulicht erzeugen. Dies illustrierte er uns nach seinem Vortrag an einem Durchflusszytometer im Labor.
Aquahaltung
Am nächsten Tag besuchten wir die Aquahaltung des DKFZs, in der verschiedene Arten von südafrikanischen Krallenfröschen gehalten werden. Die Tierpflegerin MilenaFichtmüller erklärte uns, dass die Frösche selbst nicht für Tierversuche genutzt werden, sondern ausschließlich ihr Laich. Während unseres Besuchs haben wir die Möglichkeit erhalten, die Frösche mit einem speziellen Griff selbst aus dem Becken zu holen.
Medizintechnik
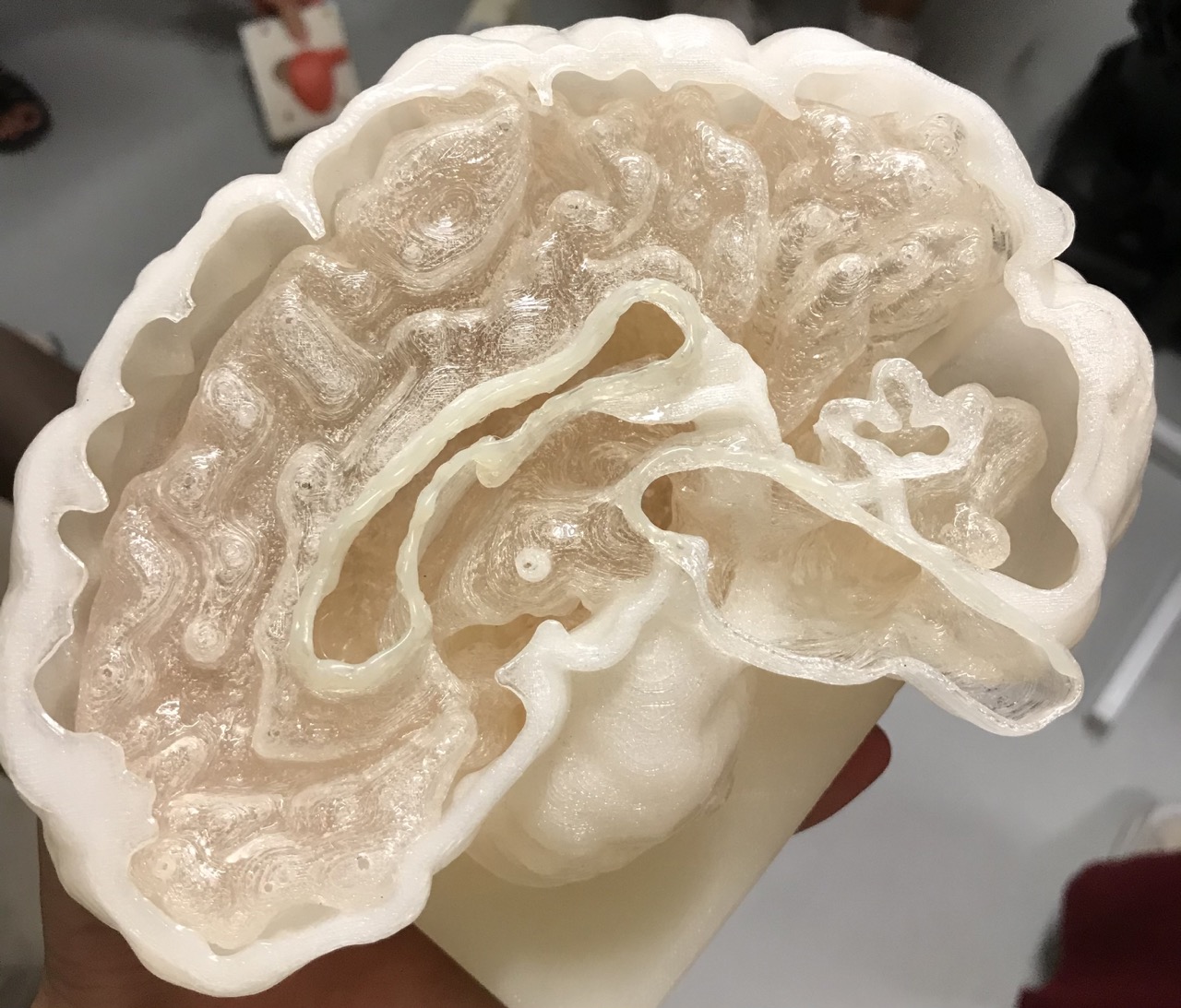
Im Anschluss erhielten wir einen Einblick in die Abteilung der Medizintechnik.Von Herrn Armin Runz erfuhren wir, dass sich der 3D-Druck in der Medizintechnik stark etabliert hat und vielseitig eingesetzt wird. Er zeigte uns einige selbstangefertigte Modelle für die Wissenschaftler des DKFZs, die diese für ihre Forschungen verwenden oder wodurch sie ein besseres Verständnis über eine geplante Operation erlangen. Unter anderem erstellten Herr Runz und sein Team mit dem 3D-Druck Modelle einer Bauchspeicheldrüse, eines Gehirns sowie einer Wirbelsäule.
Hochdurchsatz-Sequenzierung
Am vorletzten Tag unseres Praktikums besuchten wir die Abteilung für Hochdurchsatzsequenzierung. Frau Dr. Angela Schulz hielt zunächst einen Vortrag über den Ablauf der Hochdurchsatz-Sequenzierung und erläuterte uns, wie heutzutage ein Genom gelesen wird. Mit dieser Art der Sequenzierung können Genome deutlich schneller gelesen werden als mit den bisherigen Verfahren. Dadurch eröffnen sich neue Möglichkeiten, um Krebserkrankungen auf molekularer Ebene zu analysieren und zu verstehen. Zum Schluss durften wir zusammen mit Frau Dr. Schulz die Sequenzier-Geräte in den Laboren anschauen.
Konfokalmikroskopie
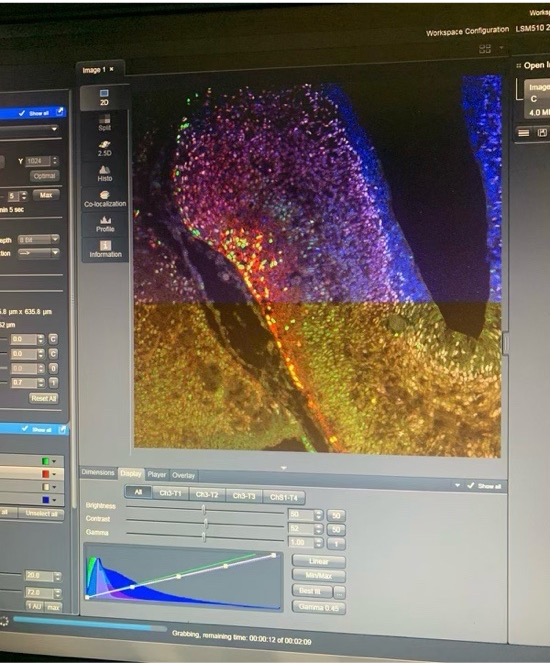
Zuletzt besuchte uns M.Sc. Daniela Kocher (Doktorandin am DKFZ) und stellte uns die Konfokalmikroskopie vor. Bevor sie uns die Arbeit am Konfokalmikroskop im Labor zeigte, führte sie uns durch eine Präsentation in die Thematik ein. Durch den Vergleich mit einem herkömmlichen Mikroskop lernten wir, dass es sich um eine besondere Art der Mikroskopie handelt, da das Präparat durch einen Laser statt durch ein LED-Licht beleuchtet wird. Dadurch lässt sich das Präparat in einzelnen Bruchstücken und in verschiedenen Ebenen analysieren. Nach dieser Einführung demonstrierte Frau Kocher uns den praktischen Umgang mit einem dieser Mikroskope und wir konnten einige interessante Gewebe untersuchen, wie z.B. das Gehirn einer Maus.
Abschließend möchten wir uns ganz herzlich bei den Auricher Wissenschaftstagen für die einmalige Chance, ein Praktikum am DKFZ in Heideberg absolvieren zu dürfen, bedanken. Die Zeit im DKFZ war für uns nicht nur lehrreich, sondern zugleich auch sehr spannend und eindrucksvoll.
Wir konnten unglaublich viele Eindrücke, Erlebnisse und Erinnerungen mitnehmen. Darüber hinaus lernten wir durch dieses Praktikum zahlreiche wunderbare Menschen kennen. Wir möchten uns daher vor allem bei Anja Klefenz und Angela Funk für die großartige Vorbereitung und Betreuung bedanken. Außerdem möchten wir uns auch noch für die zahlreichen Einblicke in die verschiedenen Abteilungen des DKFZs bedanken, insbesondere bei den jeweiligen Ansprechpartnern: Dr. Lena Hornetz, Dipl.-Phys. Jens Lang, Dr. Eva Krieghoff-Henning, Dr. Marcus Eich, Armin Runz, Milena Fichtmüller, Dr. Angela Schulz und M.Sc. Daniela Kocher.