Praktikum am Max-Planck-Institut für Entwicklungsbiologie in Tübingen
vom 3. bis zum 7. November 2014
Von Aira Bautista und Cato Stoffer
Dank der Auricher Wissenschaftstage durften wir, Aira Bautista und Cato Stoffer, beide Schülerinnen des elften Jahrgangs am Gymnasium Ulricianum Aurich, ein einwöchiges Praktikum (3. – 7.11.) am Max-Planck-Institut für Entwicklungsbiologie in Tübingen absolvieren. Wir befanden uns in der Abteilung III für Genetik, das unter der Leitung von Frau Prof. Dr. Christiane Nüsslein-Volhard steht.
Am Montagmorgen um 09:00 Uhr begann das Praktikum im Büro von unserem Betreuer Horst Geiger mit einer Sicherheitsbelehrung, deren Kenntnisse Voraussetzung für die Arbeit im Labor sind.
Unser erstes kleines Projekt bestand aus einer DNA-Retransformation in E.coli Bakterien, bei der man versucht, ein bestimmtes Gen des Ausgangsbakteriums auf ein anderes Bakterium zu übertragen und dies somit genetisch zu verändern.
Die Bakterien mit dem neu eingefügten Gen nehmen so die gleichen dazugehörigen Eigenschaften an. Unser Ausgangsbakterium besaß ein antibiotikumresistentes Gen, welches wir mithilfe von rot leuchtenden Proteinen (RFP, Red Fluorescent Protein) sichtbar machen konnten. Das bedeutet, dass die Bakterien rot leuchten, wenn das Gen erfolgreich übertragen wurde. Dazu strichen wir die Ausgangsbakterien auf ein Nährmedium mit Antibiotikum in einer Petrischale und ließen diese über Nacht im Brutschrank bei 37° C wachsen.
Parallel starteten wir ein Fischprojekt, um die Entwicklung der Zebrafische zu beobachten. Dazu setzten wir im Fischhaus 10 Fischpaare zusammen, die wir zuvor aus großen Behältern (Mouse Cages) gefangen haben, die voll mit Zebrafischmutanten waren. Die Fischpaare setzten wir dann in kleinere Mouse Cages zusammen. Unglücklicherweise fressen die Tiere ihre eigenen Eier auf. Aus diesem Grund trennten wir die Fische mit einem Gitter von ihren Eiern.
Am Dienstag holten wir die Bakterien aus dem Brutschrank. Bei genauerer Betrachtung waren bereits die rötlichen Kolonien auf dem Nährboden zu erkennen. Unter UV-Licht wurde die Farbe des RFP noch deutlicher, sie fluoreszierte orange. Um den Versuch weiter zu führen, schabten wir die Bakterien ab und gaben sie mit 5 ml Nährmedium in einen Erlenmeyerkolben. Diesen stellten wir dann in den Schüttler, damit die Bakterien sich nicht absetzten
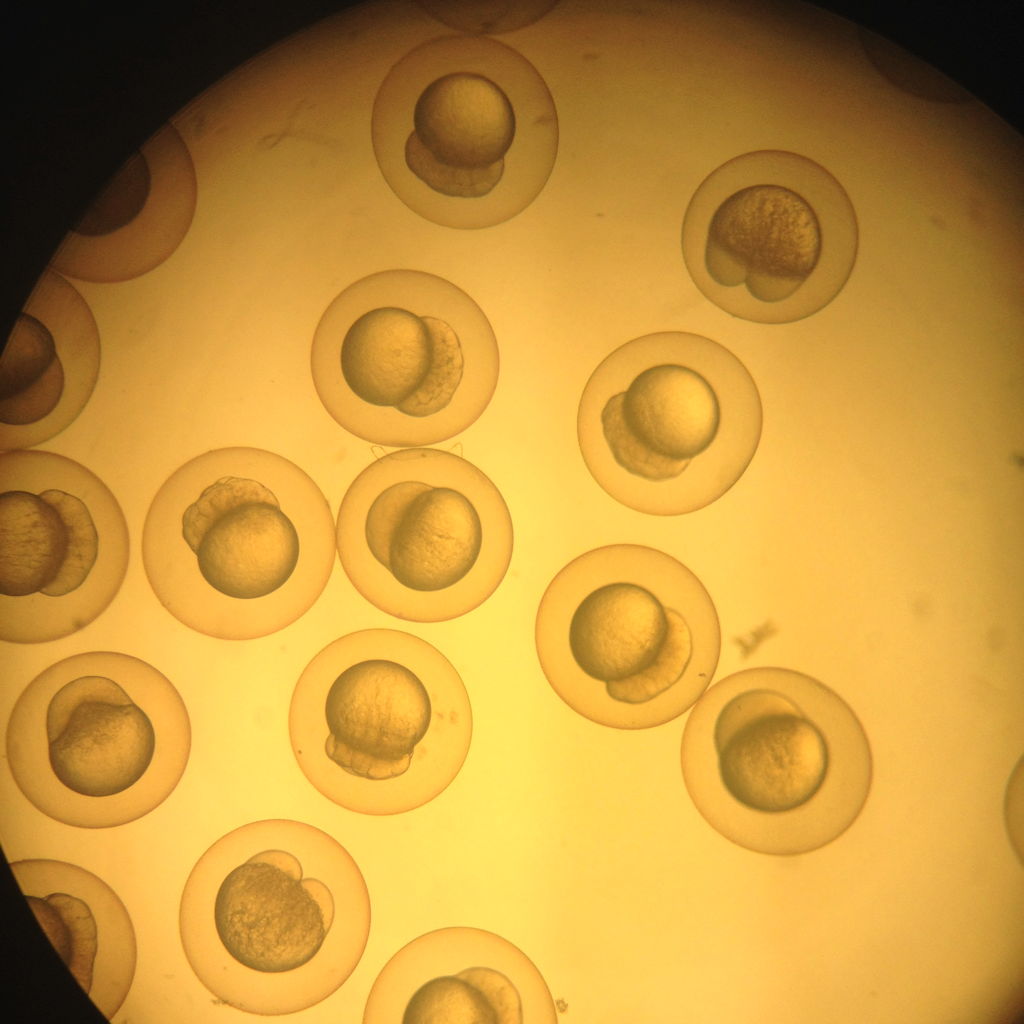
Im Folgenden schauten wir nach unseren Fischen. Da die Eier relativ groß sind, kann man sie gut unter dem Mikroskop beobachten. Deutlich zu erkennen waren die befruchteten Eier, die sich schon in unterschiedlich weit fortgeschrittenen Entwicklungsstadien befanden. Unter diesen befanden sich aber auch unbefruchtete Eier, die wir entfernten, da diese nach einer Weile anfangen würden zu schimmeln.
Nach dem Mittagessen trafen wir uns mit Mario, einem Tierpfleger, der uns zeigte, wie man die Fische füttert. Bewaffnet mit zwei Flaschen Fischfutter machten wir uns ans Werk und begannen die Regale abzuarbeiten.
Nach etwa anderthalb Stunden und 6 Regalen widmeten wir uns wieder den Bakterien. Mithilfe von vielen aufwendigen Schritten trennten wir die Plasmide, auf dem sich das Gen befindet, vom Rest des Bakteriums. Hierzu haben wir zwei Methoden ausprobiert (Säulen-Chromatographie mithilfe einer Silica-Membran und einer Alkoholpräzipitation).
Am nächsten Tag gingen wir mit Silke Geiger-Rudolph in die Fliegenabteilung. Wir haben zunächst den Wildtyp unter dem Binokular betrachtet. Dann zeigte Silke uns noch einige Mutanten, beispielsweise welche mit weißen Augen. Später erzählte uns Stefan Uwe Irion, ein Projektleiter im Institut und einer der Wenigen, der noch mit den Fliegen arbeitet, weiteres zur Geschichte der Forschung mit der Drosophila-Fliege und ihre Entwicklung selbst.
Am Nachmittag war es wieder Zeit für einen Besuch bei unseren Fischen.
Später durften wir Jürgen Berger, Techniker der Elektronenmikroskopie, beim Vorbereiten eines Präparats und bei der Mikroskopierung von Borstenwurmlarven unter dem Rasterelektronen-Mikroskop (REM) über die Schulter schauen.
Das Mikroskopieren war sehr beeindruckend, da das Präparat innerhalb des Mikroskops beliebig verschoben und gedreht werden konnte, und das Bild auf das Computerbildschirm übertragen wurde und wir somit eine sehr schöne 3D-Abbildung sehen konnten, welche wir auch ausdruckten und mitnehmen durften.
Am Ende des Tages führten wir den letzten, wichtigen Schritt von unserem Bakterienprojekt durch: die Retransformation der Gene in die neuen Bakterien. Es gab wieder einige komplizierte Durchführungsschritte zu tun, durch die wir die Plasmide mit dem Gen in die neuen Bakterien einführten. Im Anschluss pipettierten wir diese einmal auf Nährboden mit Antiobiotikum und einmal auf reinem Nährboden, um zu gucken, ob der Versuch gelungen ist und die Bakterien das Gen aufgenommen hatten.
Donnerstag schauten wir uns die Petrischalen vom Vortag an. Dabei stellten wir fest, dass auf der Petrischale mit Antibiotikum nur rote Kolonien zu sehen waren. Auf der anderen Schale waren jedoch nur weiße Bakterienkolonien zu sehen, obwohl wir vereinzelt auch Rote erwartet hatten.
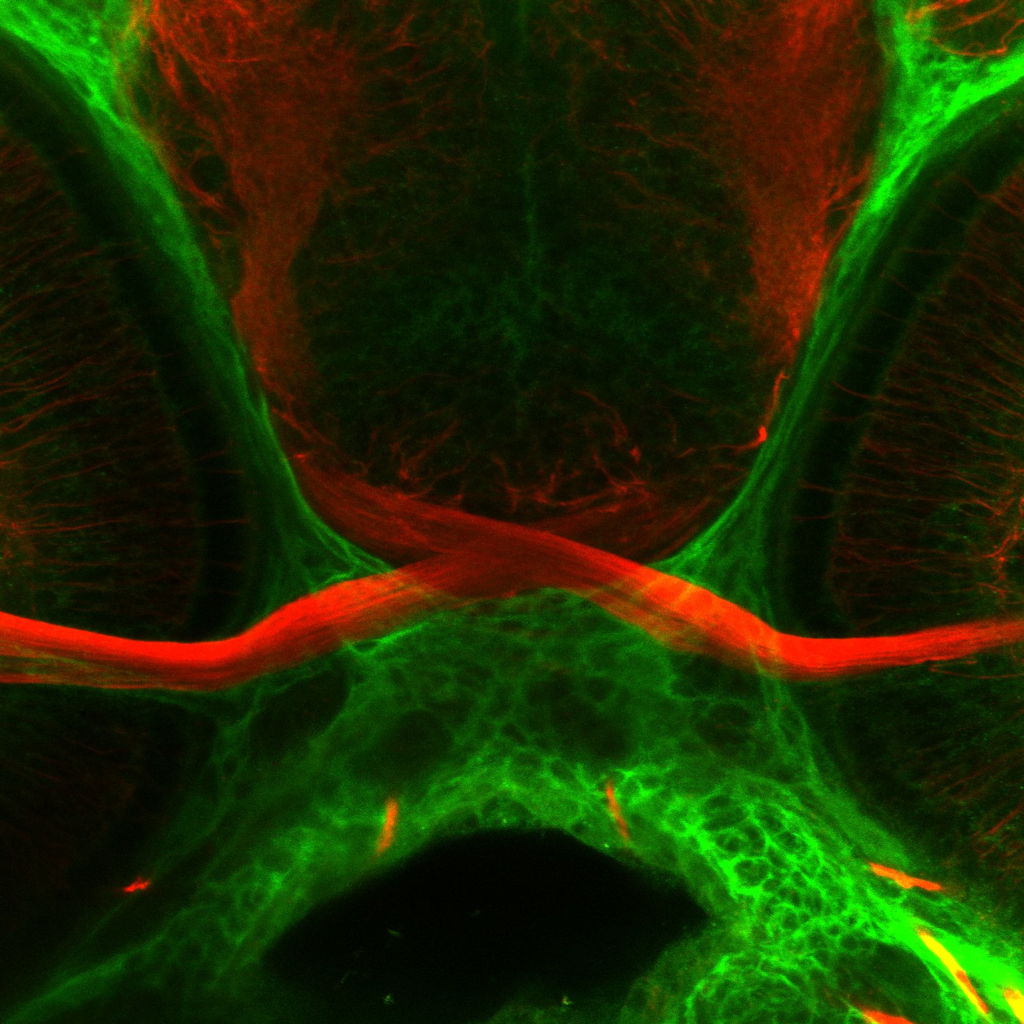
Abends hatten wir eine Verabredung mit dem PhD Studenten Paolo Panza. Er zeigte uns das konfokale Laser-Scanning-Mikroskop: 5 Live. Paolo demonstrierte uns die Funktionsweise des Mikroskops anhand seines derzeitigen Versuches, in welchem er die Nervenzellen (Sehnerven) des Zebrafisches untersuchte. Bei Paolos Präparat war die Wachstumsrichtung der Sehnerven sehr gut zu sehen. Diese wuchsen durch die Öffnungen der Augenhöhlen überkreuz zum Gehirn. Während er uns sein Vorhaben erklärte, erfuhren wir vieles über seine Erfahrungen mit dem Biologiestudium bzw. das Leben eines PhD Studenten.
An unserem letzten Tag stand die Fliegenfutteraufbereitung auf dem Plan. Mit Edith, einer Tierpflegerin, sortierten wir Röhrchen in Kästen und mischten dann das Fliegenfutter zusammen. In kochendem Wasser (dem Agarose beigefügt wurde), wird die Mischung zubereitet. Nachdem es ca. eine halbe Stunde köchelte, pumpten wir das Futter in die Röhrchen. In diesen kühlte es dann ab. Sobald die Mischung fest geworden war, fügten wir dem Ganzen ein paar Tropfen Hefe hinzu, die zuvor verflüssigt wurde.
Auch dies ließen wir zum Trocknen stehen. Zuletzt setzten wir luftdurchlässige (jedoch vor Milben schützende) Stopfen drauf. Zu unserer Überraschung erhielten wir eine Handvoll Röhrchen, die wir mitnehmen durften. Oben in der Fliegenabteilung trafen wir auf Uwe, der uns mit Fliegen und Mutanten versorgte.
Ein letztes Mal besuchten wir unsere Fische, die fast alle schon geschlüpft waren. Unter dem Fluoreszenzmikroskop sahen wir dann nochmal an Silkes Fischen ein Beispiel für Mutanten, die mit RFP ausgestattet waren.
Mit zahlreichen, neuen Erkenntnissen und Fliegen machten wir uns am Samstag, den 8. November auf dem Weg nach Hause.
Dank des MPIs, unseren Betreuern Horst und Silke Geiger und der anderen Mitarbeiter der Abteilung, die sich so viel Zeit für uns genommen haben, durften wir eindrucksvolle und aufschlussreiche Erfahrungen sammeln.
An dieser Stelle möchten wir uns herzlichst bei den Organisatoren der Auricher Wissenschaftstage Frau Groen, Frau Henschel, Herrn Antony und Herrn Siebels für die Ermöglichung dieses unvergesslichen Praktikums bedanken.